中国科学家发现:治疗阿尔茨海默病的潜在新靶点
2011年,约翰霍普金斯大学医学院的研究团队在《细胞》杂志上以封面文章的形式发表了一项开创性的研究,描述和表征了一种AAA ATP酶Thorase。Thorase位于线粒体外膜,维持线粒体质控,调节AMPA受体依赖性的突触可塑性。
研究揭示,Thorase基因的缺失会导致AMPA受体内化减少,微小的兴奋性突触后电流振幅增加,长时程增强增加,长时程抑制消除,这一系列变化最终表现为小鼠的学习和记忆缺陷。这项研究的第一作者为现任中国医学科学院/北京协和医学院免疫学系教授张建民。
在后来的研究中,研究团队又发现,Thorase过表达具有神经保护作用。近年来对三个数据库的对照分析和AD相关基因的综合蛋白质组学分析显示,Thorase是阿尔茨海默病(AD)相关血液分泌蛋白的一种。那么,Thorase在AD中究竟起到什么样的作用?是否有成为AD干预靶点的潜力?
在近期的Alzheimer’s & Dementia杂志上,张建民教授联合同样来自中国医学科学院/北京协和医学院的何维教授和陈慧副研究员带领团队发表了新研究成果。
他们发现,Thorase通过蛋白磷酸酶2B(PP2B)调节tau蛋白磷酸化,Thorase缺失会导致β淀粉样蛋白(Aβ)沉积和tau磷酸化增加,并且损害小胶质细胞的吞噬作用、促进神经炎症,反之,过表达Thorase能够减轻Aβ沉积和tau磷酸化。

由于有此前蛋白质组学和小鼠研究的基础,研究人员首先检查了AD患者脑组织中Thorase的水平,与年龄匹配的非AD患者相比,AD患者的Thorase水平较低,与此前的研究不谋而合。
于是,研究人员进一步在小鼠中进行了Thorase敲除,这导致它们与同窝的野生型小鼠相比有明显更高的磷酸化tau水平,非磷酸化tau水平则较低,总tau水平没有显著差异,磷酸化tau的增加集中在Ser396、Thr231、Thr205和Ser404位点。相应的,过表达Thorase后,Ser396、Thr231和Ser404位点的磷酸化tau都有所减少。
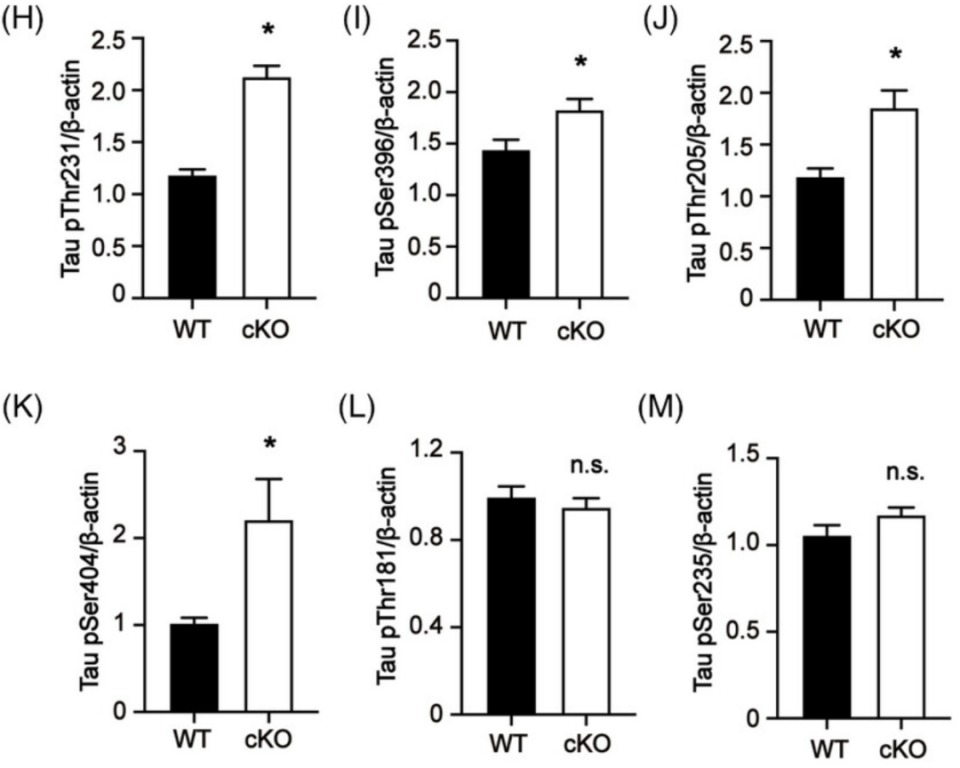
敲除小鼠(cKO)的Thr231(H)、Ser396(I)、Thr205(J)、Ser404(K)、Thr181(L)和Ser235(M)位点的tau磷酸化高于野生型小鼠(WT)
Tau磷酸化位点受到多种蛋白激酶和磷酸酶的调节,其中包含tau蛋白去磷酸化的主要磷酸酶PP2B,免疫共沉淀和Western blot分析显示,Thorase可以通过与PP2B相互作用调节以上几个位点的tau磷酸化。
AD的病理变化不是孤立的,因此,研究人员猜测,Thorase可能也调节Aβ病理,他们的猜想是正确的,敲除Thorase的APP/PS1小鼠在4月龄时就出现大量Aβ沉积,相比未敲除的APP/PS1小鼠,两种Aβ的主要形式Aβ42和Aβ40增加了3-4倍以上。与磷酸化tau的情况类似,过表达Thorase也减少了Aβ 的沉积。
在Thorase敲除小鼠大脑的Aβ斑块周围,研究人员发现了一些AD样增强的增生星形胶质细胞和活化的小胶质细胞,Aβ斑块能够刺激小胶质细胞导致细胞形变和功能障碍,研究人员也确实发现,敲除小鼠的活化小胶质细胞明显多于未敲除小鼠,静息小胶质细胞则明显减少,并且小胶质细胞中的Aβ也更少,表明小胶质细胞的吞噬能力下降。
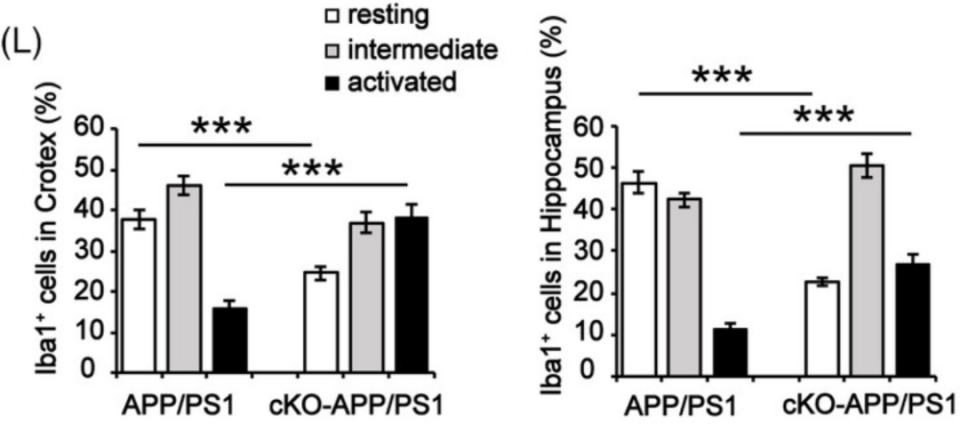
敲除小鼠(cKO)的活化小胶质细胞(黑)明显增加
这种变化通常与神经炎症有关,敲除小鼠的脑组织中,炎症蛋白小体NLRP3、Pro Caspase-1和ASC的水平都有所升高,炎症小体被激活时,炎症因子白细胞介素-1β(IL-1β)释放,因此,小鼠脑组织也有较高水平的IL-1β和肿瘤坏死因子-α(TNF-α)。
综上所述,缺少Thorase与AD相关Aβ沉积、tau磷酸化和神经炎症有关,过表达则可以减少这些病理,表明靶向Thorase的调节可能是一种减少AD病理的新型治疗策略。
